-
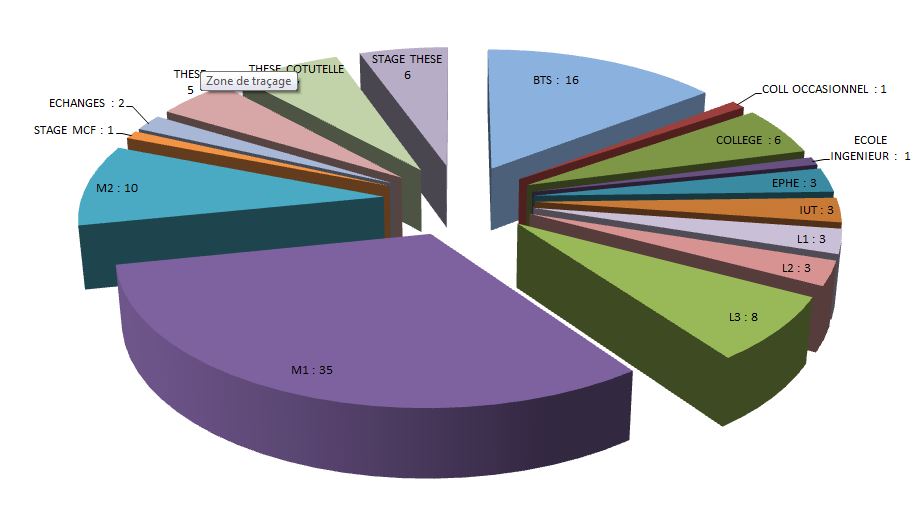
Répartition des étudiants 2012-2013
Depuis 2010, nous avons accueilli 110 étudiants selon la répartition suivante :
-
Publications du laboratoire
Liste des différentes publications du laboratoire depuis 2005 :

-
Revues

2023
2022
- Di Cara F, Savary S, Kovacs WJ, Kim P, Rachubinski RA. The peroxisome: an up-and-coming organelle in immunometabolism. Trends Cell Biol. 2023 Jan;33(1):70-86. doi: 10.1016/j.tcb.2022.06.001. Epub 2022 Jul 1.PMID: 35788297 Review.
- Salvi J, Andreoletti P, Audinat E, Balland E, Ben Fradj S, Cherkaoui-Malki M, Heurtaux T, Liénard F, Nédélec E, Rovère C, Savary S, Véjux A, Trompier D, Benani A. Microgliosis: a double-edged sword in the control of food intake. FEBS J. 2022 Jul 26. doi: 10.1111/febs.16583. Online ahead of print.PMID: 35880408 Free article. Review.
- Biasi F, Leoni V, Gamba P, Sassi K, Lizard G, Poli G. Role of 27-hydroxycholesterol and its metabolism in cancer progression: Human studies. Biochem Pharmacol. 2022 Feb;196:114618. doi: 10.1016/j.bcp.2021.114618. Epub 2021 May 21.PMID: 34023292 Free article. Review.
- Kessas K, Chouari Z, Ghzaiel I, Zarrouk A, Ksila M, Ghrairi T, El Midaoui A, Lizard G, Kharoubi O. Role of Bioactive Compounds in the Regulation of Mitochondrial Dysfunctions in Brain and Age-Related Neurodegenerative Diseases. Cells. 2022 Jan 13;11(2):257. doi: 10.3390/cells11020257.PMID: 35053373 Free PMC article. Review.
- Rezig L, Ghzaiel I, Ksila M, Yammine A, Nury T, Zarrouk A, Samadi M, Chouaibi M, Vejux A, Lizard G. Cytoprotective activities of representative nutrients from the Mediterranean diet and of Mediterranean oils against 7-ketocholesterol- and 7β-hydroxycholesterol-induced cytotoxicity: Application to age-related diseases and civilization diseases. Steroids. 2022 Nov;187:109093. doi: 10.1016/j.steroids.2022.109093. Epub 2022 Aug 24.PMID: 36029811 Review.
2021
- Tahri-Joutey M, Andreoletti P, Surapureddi S, Nasser B, Cherkaoui-Malki M, Latruffe N. Mechanisms Mediating the Regulation of Peroxisomal Fatty Acid Beta-Oxidation by PPARα. Int J Mol Sci. 2021 Aug 20;22(16):8969. doi: 10.3390/ijms22168969.PMID: 34445672 Free PMC article. Review.
- Tawbeh A, Gondcaille C, Trompier D, Savary S. Peroxisomal ABC Transporters: An Update. Int J Mol Sci. 2021 Jun 5;22(11):6093. doi: 10.3390/ijms22116093.PMID: 34198763 Free PMC article. Review.
- Yammine A, Namsi A, Vervandier-Fasseur D, Mackrill JJ, Lizard G, Latruffe N.Polyphenols of the Mediterranean Diet and Their Metabolites in the Prevention of Colorectal Cancer. Molecules. 2021 Jun 8;26(12):3483. doi: 10.3390/molecules26123483.PMID: 34201125 Free PMC article. Review.
- Nury T, Yammine A, Ghzaiel I, Sassi K, Zarrouk A, Brahmi F, Samadi M, Rup-Jacques S, Vervandier-Fasseur D, Pais de Barros JP, Bergas V, Ghosh S, Majeed M, Pande A, Atanasov A, Hammami S, Hammami M, Mackrill J, Nasser B, Andreoletti P, Cherkaoui-Malki M, Vejux A, Lizard G. Attenuation of 7-ketocholesterol- and 7β-hydroxycholesterol-induced oxiapoptophagy by nutrients, synthetic molecules and oils: Potential for the prevention of age-related diseases. Ageing Res Rev. 2021 Jul;68:101324. doi: 10.1016/j.arr.2021.101324. Epub 2021 Mar 24.PMID: 33774195 Review.
- Charrière K, Ghzaiel I, Lizard G, Vejux A. Involvement of Microglia in Neurodegenerative Diseases: Beneficial Effects of Docosahexahenoic Acid (DHA) Supplied by Food or Combined with Nanoparticles. Int J Mol Sci. 2021 Sep 30;22(19):10639. doi: 10.3390/ijms221910639.PMID: 34638979 Free PMC article. Review.
2020
- Lizard G, Latruffe N, Vervandier-Fasseur D. Aza- and Azo-Stilbenes: Bio-Isosteric Analogs of Resveratrol. Molecules. 2020 Jan 30;25(3):605. doi: 10.3390/molecules25030605.PMID: 32019195 Free PMC article. Review.
- Wu A, Wojtowicz K, Savary S, Hamon Y, Trombik T. Do ABC transporters regulate plasma membrane organization? Cell Mol Biol Lett. 2020 Jul 6;25:37. doi: 10.1186/s11658-020-00224-x. eCollection 2020.PMID: 32647530 Free PMC article. Review.
- Delmas D, Xiao J, Vejux A, Aires V. Silymarin and Cancer: A Dual Strategy in Both in Chemoprevention and Chemosensitivity. Molecules. 2020 Apr 25;25(9):2009. doi: 10.3390/molecules25092009.PMID: 32344919 Free PMC article. Review.
- Silva P, Latruffe N, Gaetano G.Wine Consumption and Oral Cavity Cancer: Friend or Foe, Two Faces of Janus.Molecules. 2020 May 31;25(11):2569. doi: 10.3390/molecules25112569.PMID: 32486484 Free PMC article. Review.
- Latruffe N.Human Peroxisomal 3-Ketoacyl-CoA Thiolase: Tissue Expression and Metabolic Regulation : Human Peroxisomal Thiolase. Adv Exp Med Biol. 2020;1299:161-167. doi: 10.1007/978-3-030-60204-8_12.PMID: 33417214 Review.
- Masmoudi-Kouki O, Namsi A, Hamdi Y, Bahdoudi S, Ghouili I, Chuquet J, Leprince J, Lefranc B, Ghrairi T, Tonon MC, Lizard G, Vaudry D. Cytoprotective and Neurotrophic Effects of Octadecaneuropeptide (ODN) in in vitro and in vivo Models of Neurodegenerative Diseases. Front Endocrinol (Lausanne). 2020 Nov 4;11:566026. doi: 10.3389/fendo.2020.566026. eCollection 2020.PMID: 33250858 Free PMC article. Review.
2019
- Vervandier-Fasseur D, Latruffe N. The Potential Use of Resveratrol for Cancer Prevention. Molecules. 2019 Dec 9;24(24):4506. doi: 10.3390/molecules24244506.PMID: 31835371 Free PMC article. Review.
- Di Cara F, Andreoletti P, Trompier D, Vejux A, Bülow MH, Sellin J, Lizard G, Cherkaoui-Malki M, Savary S. Peroxisomes in Immune Response and Inflammation. Int J Mol Sci. 2019 Aug 8;20(16):3877. doi: 10.3390/ijms20163877.PMID: 31398943 Free PMC article. Review.
- Brahmi F, Vejux A, Sghaier R, Zarrouk A, Nury T, Meddeb W, Rezig L, Namsi A, Sassi K, Yammine A, Badreddine I, Vervandier-Fasseur D, Madani K, Boulekbache-Makhlouf L, Nasser B, Lizard G. Prevention of 7-ketocholesterol-induced side effects by natural compounds. Crit Rev Food Sci Nutr. 2019;59(19):3179-3198. doi: 10.1080/10408398.2018.1491828. Epub 2018 Oct 16.PMID: 29993272 Review.
- Dias IH, Borah K, Amin B, Griffiths HR, Sassi K, Lizard G, Iriondo A, Martinez-Lage P. Localisation of oxysterols at the sub-cellular level and in biological fluids. J Steroid Biochem Mol Biol. 2019 Oct;193:105426. doi: 10.1016/j.jsbmb.2019.105426. Epub 2019 Jul 10.PMID: 31301352 Review.
- Silva P, Sureda A, Tur JA, Andreoletti P, Cherkaoui-Malki M, Latruffe N. How efficient is resveratrol as an antioxidant of the Mediterranean diet, towards alterations during the aging process? Free Radic Res. 2019;53(sup1):1101-1112. doi: 10.1080/10715762.2019.1614176. Epub 2019 Oct 7.PMID: 31039629 Review.
- Koss-Mikołajczyk I, Baranowska M, Todorovic V, Albini A, Sansone C, Andreoletti P, Cherkaoui-Malki M, Lizard G, Noonan D, Sobajic S, Bartoszek A. Prophylaxis of Non-communicable Diseases: Why Fruits and Vegetables may be Better Chemopreventive Agents than Dietary Supplements Based on Isolated Phytochemicals? Curr Pharm Des. 2019;25(16):1847-1860. doi: 10.2174/1381612825666190702093301.PMID: 31267861 Review.
2018
2016
- Dutartre P. Inflammasomes and Natural Ingredients towards New Anti-Inflammatory Agents. Molecules. 2016 Nov 8;21(11):1492. doi: 10.3390/molecules21111492.PMID: 27834826 Free PMC article. Review.
- Lançon A, Frazzi R, Latruffe N. Anti-Oxidant, Anti-Inflammatory and Anti-Angiogenic Properties of Resveratrol in Ocular Diseases. Molecules. 2016 Mar 2;21(3):304. doi: 10.3390/molecules21030304.PMID: 26950104 Free PMC article. Review.
2015
2014
- Trompier D, Vejux A, Zarrouk A, Gondcaille C, Geillon F, Nury T, Savary S, Lizard G. Brain peroxisomes. Biochimie. 2014 Mar;98:102-10. doi: 10.1016/j.biochi.2013.09.009. Epub 2013 Sep 21.PMID: 24060512 Review.
- El-Mostafa K, El Kharrassi Y, Badreddine A, Andreoletti P, Vamecq J, El Kebbaj MS, Latruffe N, Lizard G, Nasser B, Cherkaoui-Malki M. Nopal cactus (Opuntia ficus-indica) as a source of bioactive compounds for nutrition, health and disease. Molecules. 2014 Sep 17;19(9):14879-901. doi: 10.3390/molecules190914879.PMID: 25232708 Free PMC article. Review.
- Vamecq J, Cherkaoui-Malki M, Andreoletti P, Latruffe N. The human peroxisome in health and disease: the story of an oddity becoming a vital organelle. Biochimie. 2014 Mar;98:4-15. doi: 10.1016/j.biochi.2013.09.019. Epub 2013 Sep 26.PMID: 24075875 Review.
- Trompier D, Gondcaille C, Lizard G, Savary S.Regulation of the adrenoleukodystrophy-related gene (ABCD2): focus on oxysterols and LXR antagonists. Biochem Biophys Res Commun. 2014 Apr 11;446(3):651-5. doi: 10.1016/j.bbrc.2014.01.025. Epub 2014 Jan 27.PMID: 24480443 Review.
- Latruffe N, Menzel M, Delmas D, Buchet R, Lançon A. Compared binding properties between resveratrol and other polyphenols to plasmatic albumin: consequences for the health protecting effect of dietary plant microcomponents. Molecules. 2014 Oct 24;19(11):17066-77. doi: 10.3390/molecules191117066.PMID: 25347454 Free PMC article. Review.
2013
2012
- Geillon F, Trompier D, Gondcaille C, Lizard G, Savary S. [Peroxisomal ABC transporters and X-linked adrenoleukodystrophy]. Med Sci (Paris). 2012 Dec;28(12):1087-94. doi: 10.1051/medsci/20122812019. Epub 2012 Dec 21.PMID: 23290409 Free article. Review. French.
- Savary S, Trompier D, Andréoletti P, Le Borgne F, Demarquoy J, Lizard G. Fatty acids - induced lipotoxicity and inflammation. Curr Drug Metab. 2012 Dec;13(10):1358-70. doi: 10.2174/138920012803762729.PMID: 22978392 Review.
- Cherkaoui-Malki M, Surapureddi S, El-Hajj HI, Vamecq J, Andreoletti P. Hepatic steatosis and peroxisomal fatty acid beta-oxidation. Curr Drug Metab. 2012 Dec;13(10):1412-21. doi: 10.2174/138920012803762765.PMID: 22978396 Review.
- Chamouton J, Latruffe N. PPARα/HNF4α interplay on diversified responsive elements. Relevance in the regulation of liver peroxisomal fatty acid catabolism. Curr Drug Metab. 2012 Dec;13(10):1436-53. doi: 10.2174/138920012803762738.PMID: 22978398 Review.
2011
- Delmas, D., Solary, E., and Latruffe, N. Resveratrol, a phytochemical inducer of multiple cell death pathways: apoptosis, autophagy and mitotic catastrophe. Curr Med Chem 18(8): 1100-1121, (2011).
- Latruffe, N. Resveratrol acts by modulating miRNAs. Med Sci (Paris) 27(1): 31-33, (2011).
- Tili, E., and Michaille, J.J. Resveratrol, MicroRNAs, Inflammation, and Cancer. J Nucleic Acids 2011: 102431, (2011).
- Vejux, A., Samadi, M., and Lizard, G. Contribution of cholesterol and oxysterols in the physiopathology of cataract: implication for the development of pharmacological treatments. J Ophthalmol 2011: 471947, (2011).
2010
- Latruffe, N. La signalisation cellulaire anti-inflammatoire et anticancéreuse du resvératrol passe par la modulation de microARN. Regard sur la biochimie(oct): 9-10, (2010).
2009
-
Betsou F, Beaudeux JL, Berthelaix A, Borg J, Dupuy A, Lizard G, Peoc'h K, Quillard M, Lehmann S. Standard protocol for evaluating the impact of preanalytical variables on peptidic and proteic analytes and standard coding of preanalytical procedures. Ann Biol Clin. (Paris). 2009; 67(6): 641-649. IF moy 0.38
-
Elbim C, Lizard G. Flow cytometric investigation of neutrophil oxidative burst and apoptosis in physiological and pathological situations. (review) Cytometry A. 2009; 75(6):475-481. IF moy 3.21
-
Lehmann S, Dupuy A, Beaudeux JL, Lizard G. Multiplexed analysis for identification and evaluation of novel biomarkers in biological fluids, tissue and cell extracts. Ann Biol Clin. (Paris). 2009; 67 (4): 381-393. IF moy 0.36
-
Vejux A, Lizard G. Cytotoxic effects of oxysterols associated with human diseases: Induction of cell death (apoptosis and/or oncosis), oxidative and inflammatory activities, and phospholipidosis. Mol Aspects Med. 2009 Jun;30:153-70.
2008
-
Vejux A, Malvitte L, Lizard G. Side effects of oxysterols: cytotoxicity, oxidation, inflammation, and phospholipidosis. Braz J Med Biol Res. 2008; 41: 545-456. IF moy 1.215
2007
-
Tili E, Michaille JJ, Gandhi V, Plunkett W, Sampath D, Calin GA. miRNAs and their potential for use against cancer and other diseases. Future Oncol. 2007; 3: 521-537.
2005
-
Delmas D, Jannin B, Latruffe N Resveratrol: preventing properties against vascular alterations and ageing. Mol Nut Food Res, 2005, 49: 377-95 IF moy 4.24 (review)
-
Montange T, Vejux A, Labenne M, Poncelet P, Gouyon JB, Lizard G. Cytométrie en flux, microbilles et analyses biomoléculaires multiplexées. Immunoanalyse & Biologie Spécialisée, 2005, 20 : 2-10. (review)
-
Bardon S, Benelli C, Bernard-Gallon D, Blottiere H, Demarquoy J, Duee PH, Forest C. Dietary fatty acids and cancer: potential cellular and molecular mechanisms. Bull Cancer, 2005, 92: 697-707. (review)
-
Mandard S, Kersten S. Regulation of lipogenic genes in obesity. In: Nutritional Genomics: Nutrients, Genes and Genetic Variation in Health and Disease. 2005. Wiley-VCH (review)
-
Editoriaux
- Cell Death, Inflammation and Oxidative Stress in Neurodegenerative Diseases: Mechanisms and Cytoprotective Molecules. Anne Vejux, MDPI Book. 2022 - ISBN 978-3-0365-2910-3 (Hbk); ISBN 978-3-0365-2911-0 (PDF), https://doi.org/10.3390/books978-3-0365-2911-0
- Lizard G, Poirot M, Iuliano L. Celebrating the 10th anniversary of the creation of the European Network for Oxysterol Research (ENOR) Editorial J Steroid Biochem Mol Biol. 2022 Apr 11;106114. doi: 10.1016/j.jsbmb.2022.106114. Online ahead of print.
- Lizard G, Poirot M, Iuliano L, Roberg-Larsen H, Thorne J, Olkkonen V, Griffiths WJ, Lutjohann D, Wilson SRH. ENOR's webmeeting 2021.
- Lütjohann D, Lizard G, Iuliano L. Oxysterols: Players in different metabolic leagues. J Steroid Biochem Mol Biol. 2017 May; 169:1-3.
- Massaad C, Iuliano L, Lizard G. Oxysterols and phytosterols in human health. Chem Phys Lipids. 2017; 207:49-50.
- Muccioli GG, Lizard G, Iuliano L. Current trends in oxysterols & related sterols.Biochimie. 2018 Oct;153:1-2. doi: 10.1016/j.biochi.2018.08.008. Epub 2018 Sep 1. No abstract available. - PMID: 30176264
- Rodriguez-Estrada MT, Cardenia V, Poirot M, Iuliano L, Lizard G. Oxysterols and sterols: From lipidomics to food sciences. J Steroid Biochem Mol Biol. 2020 Feb;196:105515. doi: 10.1016/j.jsbmb.2019.105515. Epub 2019 Oct 28. PMID: 31672618.
- Iuliano L, Lizard G. Oxysterols and related sterols in chemistry, biology and medicine: a dynamic European field of investigation. Biochimie. 2013;95:445-447. IF 3.1
- Cherkaoui-Malki, M. A tribute to Christian de Duve (1917-2013). Biochimie 98: 1-3, (2014).
- Iuliano, L., and Lizard, G. Oxysterols and related sterols in chemistry, biology and medicine: a dynamic European field of investigation. Biochimie 95(3): 445-447, (2013).
- Cherkaoui-Malki, M. Editorial: lipohepatotoxicity and nonalcoholic steatohepatitis (NASH)-like metabolic disorders. Curr Drug Metab 13(10): 1357, (2012).
- Schmitz, G., Lizard, G., and Iuliano, L. Special issue to LipidomicNet and ENOR Joint Workshop (19-20 November 2010; Munich, Germany) "Analysis and function of oxysterols and other regulatory and lipotoxic molecular lipid species". Chem Phys Lipids 164(6): 409-410, (2011).
-
Procédure d'utilisation des pièces de culture
1/ Avant la manip, réservez votre créneau sur le planning affiché sur les portes des pièces. Inscription obligatoire.
2/ Toutes les pièces sont en confinement 2 c’est-à-dire que toutes les lignées cellulaires sont manipulées en confinement 2 (même les lignées de classe 1).
3/ Pour manipuler, entrez directement sans blouse dans le sas, lavez-vous les mains puis lorsque vous êtes dans le L2 enfilez la blouse jetable et les gants recommandés en niveau 2 (les blouses en cours d’utilisation seront stockées dans leur sachet plastique d’origine avec le nom du propriétaire, dans la caisse sous l’évier et ne sortiront pas de la pièce). Vous quitterez donc blouse et gants avant de sortir de la pièce. Quand nécessaire, jetez la blouse dans la poubelle jaune (le stock neuf de blouses jetables se trouve dans l’entrée du bloc 215).
En raison de la pressurisation des pièces, pensez à refermez systématiquement les portes du sas et des pièces derrière vous.
4/ Allumez le PSM une dizaine de minutes avant l’utilisation. Nettoyez rapidement le PSM à l’éthanol. Avant chaque manipulation, nettoyez à l’éthanol la poubelle « déchets liquides » (pot en plastique ou en alu) avant de l’installer dans l’enceinte du PSM.
5/ Le premier utilisateur de la journée vide la poubelle d’effluents javellisés à l’évier (notée « décontamination à la Javel pendant 12h »), laisse couler 2-3 minutes l’eau du robinet et remet un fond d’eau de Javel dans la poubelle.
6/ Respectez les consignes d’utilisation du PSM :
- pas de stockage sous le PSM
- limiter le nombre de tubes et de boîtes
- manipuler au plus loin de la veine de garde
- ne pas s’appuyer sur la veine de garde
- ne pas faire couler de milieu sous le plateau, sinon nettoyer7/ Respectez les consignes d’utilisation des autres matériels de la pièce :
- veiller à ne pas aspirer de milieu jusque dans le filtre du pipetaid, sinon changer le filtre
- mettre en charge le pipetaid après utilisation
- vérifier que l’incubateur est bien fermé
- nettoyer les pompes à vide permettant d’aspirer le milieu de la manière suivante :
o rincer le tuyau en faisant aspirer de l’eau du robinet puis de l’éthanol
o mettre un fond de javel dans la fiole en début de journée, vider la fiole en fin de journée ou dès qu’elle est remplie aux 2/38/ Elimination des déchets
- en fin de manip, ajoutez une goutte de javel dans la poubelle « déchets liquides » sous le PSM, transvasez ensuite dans la poubelle pour effluents javellisés
- évacuer les déchets biologiques solides dans la poubelle jaune, les déchets non biologiques dans le sac noir, dans le SAS
- les poubelles jaunes ne sortent des pièces de culture que lorsqu’elles ont été fermées hermétiquement9/ Fin de la manipulation
- nettoyez le PSM à l’eau (si milieu renversé) puis à l’alcool
- faites-le fonctionner encore une dizaine de minutes
- lavez-vous les mains avant de sortir du sas10/ Entretien du matériel
- 1 fois/mois les PSM, incubateurs et bain-Marie sont nettoyés selon les consignes affichées sur les appareils
- pensez également à nettoyer régulièrement à l’éthanol les paillasses, les boutons des centrifugeuses, les plate-formes, molettes et oculaires des microscopes, les poignées et portes des incubateurs et des pièces11/ Alimentation et répartition du consommable plastique
- le consommable en emballage unitaire (pipettes 25,10, 5 ml, plaques x puits) ainsi que les sachets de boîtes de Pétri ou de flacons, les cryotubes, les tubes de 15 et 50 ml sont communs. Pensez à vérifier et au besoin à renouveler les stocks avant de quitter la pièce
- le consommable de type boite de Pétri, bocaux de tubes eppendorf ou boîtes de pointes sont personnels. Chacun veillera donc à indiquer son nom dessus et à les ranger dans les placards.Lire la suite : Procédure d'utilisation des pièces de culture
-
Tri des déchets
- voir l’assistante de prévention pour l’approvisionnement et l’élimination des poubelles de déchets spécifiques (acides, bases, solvants, CMR, emballages souillés, déchets biologiques)
Déchets biologiques :
- Milieux liquides :
Ils doivent être décontaminés par l’eau de Javel quel que soit leur niveau de confinement. Laisser décontaminer une nuit minimum puis jeter à l’évier.
- Solides :
Boîtes de Petri, gants, papier absorbant, flacons de culture, tubes divers, corps de seringues, pointes et pipettes… contaminés doivent être jetés dans les poubelles jaunes quels que soient le niveau de confinement et l’espèce d’origine de la souche bactérienne ou de la lignée cellulaire. Les pipettes seront évacuées dans les poubelles jaunes en plastique, le reste dans les poubelles jaunes en carton.
Ces poubelles jaunes sont disponibles soit dans le local « bouteilles de gaz » à coté du sas de culture soit sous la paillasse de bactério. Quand elles sont pleines, les stocker dans l’entrée du bloc de culture (à côté des bobines de papier).Cadavres d’animaux (rat et souris habituellement) :
Les restes d’organes ou d’animaux sont à descendre dans un sac poubelle fermé, dans le congélateur de l’animalerie de notre aile.
Objets piquants ou coupants (souillés ou non par des cellules ou tissus…) :

Aiguilles, scalpels, lames de cutter…
Risques : de blessures ou de piqûres associés éventuellement à une contamination (biologique ou chimique)
Tri : Stocker dans les emballages jaunes de type « boîtes à aiguilles » mis à disposition dans les salles de manips. Ne pas reboucher les aiguilles avant de les jeter (risque de blessure)
Produits cancérigènes, mutagènes ou reprotoxiques (CMR) :

Risques :Toxicité par ingestion, inhalation, pour les yeux, les voies respiratoires et la peau selon le produit considéré
Tri :
- Gels, tubes, pointes, pipettes en plastique ou verre… souillés : dans les seaux blancs
- Tampons : dans le bidon blanc et bleu noté « déchets toxiques liquides » (sous la paillasse d’électrophorèse, salle 212)
Acides, bases et liquides organiques inflammables :
Risques : Toxicité pour la peau et les muqueuses (oculaire, nasale, respiratoire, digestive).
Tri : Des bidons de stockage avec étiquette sont prévus pour chaque catégorie et entreposés dans les salles 206 et 207.
Etiquette rouge : pour les liquides organiques inflammables (2 bidons)
1. Liquides organiques inflammables chlorés
2. Liquides organiques inflammables non-chlorésEtiquette verte : pour les bases fortes
Etiquette jaune : pour les acides forts
Attention aux produits incompatibles (voir fiche technique en annexe et affichée à proximité des bonbonnes)
Si vous avez un doute, demander conseil à l’ACMO ou à Michel Saunier (sous-sol aile nord Gabriel)
NE JAMAIS METTRE D’ACIDE NITRIQUE DANS LES BIDONS !Déchets de type verre ou verrerie et emballages :
- verre ordinaire (bouteille de vin vide, verre à boire) : à stocker dans la bassine bleue de la cuisine qui sera vidée régulièrement par Marie-Geneviève (dans les conteneurs à verre au sous-sol). Rincer les bouteilles avant de les jeter.
- verrerie de laboratoire cassée (éprouvette, erlenmeyer, bécher…) : à stocker dans un seau blanc (sous évier, salle 210).
- emballage en verre, métal ou plastique souillé par des produits chimiques (dangereux ou non) : à stocker dans la grosse poubelle noir sous l’évier salle 210. Remettre les bouchons sur les emballages pour qu’il n’y ait pas de fuite de produit. Ne pas rincer les flacons avant de les jeter.
Produits chimiques purs ou concentrés ne pouvant être éliminés dans les containeurs cités ci-dessus:

- laisser dans l’emballage d’origine avec l’étiquetage en bon état
- donner à l’assistante de prévention qui se chargera de son évacuation
Voir aussi en annexe la « procédure de tri et d’élimination des déchets chimiques » rédigée par le service d’H & S de l’Université.
Annexes
Symboles et indications de danger (ancienne signalétique)

Symboles et indications de danger (nouvelle signalétique)

-
Fonctionnement général
Autoclavage et stérilisation :
- soit avec le petit autoclave (salle 209). Pour la première utilisation, demander conseil à un utilisateur régulier ou à l'assistant de prévention.
- soit avec l’autoclave commun avec le labo du rez-de-chaussée de notre aile, pour les pointes et tubes de préférence, car il existe une étape de séchage avec cet appareil (salle R12, rez-de-chaussée, voir avec Marie-Geneviève)
Eau : (salle 209)
 Le système de purification d'eau permet d'avoir :
Le système de purification d'eau permet d'avoir :. de l'eau distillée (gros réservoir blanc). Cette eau est utilisée pour le rinçage de la vaisselle, pour alimenter la machine à glace, pour préparer des tampons d’électrophorèse...
. de l'eau ultra pure (= MilliQ). Elle est utilisée pour faire des solutions nécessitant une qualité d’eau DNase-, RNase-free.
- Ne pas toucher à l'appareil MilliRO.
- Veiller à toujours bien refermer les robinets d'eau distillée et d'eau MilliQ.
Vaisselle :
- Chaque personne est responsable de sa vaisselle sale (ou de celle de son équipe).
- Laver les éprouvettes en verre à la main (elles cassent au lave-vaisselle) puis les rincer à l'eau du robinet puis à l'eau distillée.
- Conserver les pipettes en verre sales et les laver à la machine.
- Ne pas stocker de vaisselle sale sur les bords des éviers (on ne sait plus si c’est propre ou sale ; c’est en déséquilibre, on risque de faire de la casse et de se blesser...).
- Rincer rapidement la vaisselle sale avant de la mettre dans les bacs (sinon il reste des cristaux ou de l’agarose au fond des béchers ce qui bouche le lave vaisselle au moment du lavage...).
- Ranger la vaisselle propre dans les placards en respectant l’organisation. Ranger les flacons avec leur bouchon. Recouvrir les fioles et erlens d'un morceau de papier alu (pour éviter la poussière). Attention, les bouteilles et bouchons marqués CC sont destinés à la culture cellulaire et doivent être autoclavés puis stockés en salle de culture (les flacons marqués BM et ceux sans indication étant destinés aux solutions de biochimie ou biologie moléculaire).
- Bien fermer les vitres des placards pour éviter la poussière.
Produits chimiques : (salle 209)
- La pesée des produits s’effectue soit sur la balance en salle 209 pour les produits sans risque, soir sur la balance salle 210, sous la sorbonne, pour les produits à risque
- Ne pas mélanger les produits non-dangereux (étagères) et les produits à risques (armoire grise ou armoire acides-bases).
- Respecter le rangement par ordre alphabétique des produits.
- Après pesée, nettoyer soigneusement les balances et leurs environs (pas avec un pinceau, ça soulève les poussières, mais avec du papier absorbant humide).
- Avant qu’un produit vienne à manquer, le mettre en commande.
- Après utilisation du pHmètre, nettoyer la sonde à l'eau MilliQ abondamment puis remettre la sonde dans la solution de stockage (KCl 3 M).
- Le bromure d’éthidium se manipule uniquement en salle 212 : zone à gauche en entrant jusqu’à l’évier, et à droite en entrant jusqu’au bout de la paillasse d’électrophorèse. Aucun matériel ayant été en contact avec du BET ne doit sortir de cette pièce. Les poubelles pour liquides et solides contaminés au BET se trouvent sous la paillasse d’électrophorèse. Idem pour l’acrylamide qui se manipule sur la paillasse de gauche de cette même pièce.
- Les autres CMR tels que l’iodure de propidium, l’acridine orange, le crystal violet, le Hoechst 33342… sont manipulés uniquement en salle 211 sous sorbonne.
Azote et bouteilles de gaz :

- Une bouteille doit toujours être attachée par une chaîne (au mur ou sur le chariot).
- Pour le transport d’une bouteille (sur le chariot), entre le labo et le sous-sol, utiliser l’ascenseur mais uniquement pour la bouteille (ne pas « accompagner » la bouteille).
- Respecter les consignes de manipulation des bouteilles de gaz affichées à proximité des bouteilles.
Culture cellulaire : (voir annexe)
- Lavage des mains : savonner 30 secondes, rincer à l’eau puis à l’éthanol.
- Les salles de culture sont pressurisées, penser à refermer correctement et doucement les portes derrière soi.
- Veiller à l’entretien du matériel (hottes, incubateurs, bain-marie, centrifugeuses) et à l’approvisionnement des incubateurs en CO2.
Utilisation du matériel
-
- Veiller à bien refermer les portes des frigos, congélateurs et de la machine à glace.
- Limiter le temps d’ouverture des congélateurs (sinon ça fait plein de glace !).
- Couper les vannes d’arrivée de gaz après usage.
- En prévision de l’utilisation des centrifugeuses, thermocyclers, sécheurs de gel, appareillage d’électrophorèse..., réserver quelques jours avant (se noter sur un post-it ou sur un calendrier).
- Demander conseil pour la première utilisation des centrifugeuses (et de tout autre appareil).
- Après mise en route d’une centrifugeuse, attendre jusqu’à ce qu’elle atteigne la vitesse voulue. Si on entend un bruit bizarre, stopper immédiatement la CF et vérifier le positionnement et l’équilibrage des tubes.
- Veiller à toujours enlever les rotors des grosses centrifugeuses après utilisation et les ranger dans leur portoir en polystyrène pour qu’ils sèchent. Les laver (avec le détergent prévu à cet effet) et les rincer à l’eau si nécessaire (en particulier si contamination bactérienne lors des maxiprep d’ADN).
- Remplir le cahier d’utilisation pour les CF JA-20, JA-14 et ultra-CF.
- Micro-ondes : pas de pièce métalliques à l’intérieur (spatules, papier alu...)
- Sorbonnes : pour une bonne utilisation, descendre la vitre au niveau du trait noir, sinon elle sonne car l’extraction d’air n’est pas correcte.
- En cas de problème sur un appareil, consulter la liste des responsables des équipements et avertir la personne concernée.
Quelques remarques sur l'utilisation du matériel :
- Veiller à bien refermer les portes des frigos, congélateurs et de la machine à glace.
- Limiter le temps d’ouverture des congélateurs (sinon ça fait plein de glace !).
- Couper les vannes d’arrivée de gaz après usage.
- Ne pas utiliser de bec Bunsen sous la petite hotte de bactério.
- Nettoyer le banc UV après utilisation et vérifier régulièrement le bon fonctionnement des tubes UV.
- Avant d’ouvrir une boîte de films autoradiographiques, s’assurer que la porte de la pièce est bien fermée à clef. Manipuler les films dans le noir ou sous une lampe rouge de très faible intensité.
- En prévision de l’utilisation des centrifugeuses, thermocyclers, sécheurs de gel, appareillage d’électrophorèse..., réserver quelques jours avant (se noter sur un post-it ou sur un calendrier).
- Demander conseil pour la première utilisation des centrifugeuses (et de tout autre appareil).
- Après mise en route d’une centrifugeuse, attendre jusqu’à ce qu’elle atteigne la vitesse voulue. Si on entend un bruit bizarre, stopper immédiatement la CF et vérifier le positionnement et l’équilibrage des tubes.
- Veiller à toujours enlever les rotors des grosses CF après utilisation et les ranger dans leur portoir en polystyrène pour qu’ils sèchent. Les laver (avec le détergent prévu à cet effet) et les rincer à l’eau si nécessaire (en particulier si contamination bactérienne lors des maxiprep d’ADN).
- Remplir le cahier d’utilisation pour les CF JA-20, JA-14 et ultra-CF.
- Micro-ondes : pas de pièce métalliques à l’intérieur (spatules, papier alu...).
- Spectrophotomètre : éviter un allumage intempestif. Cela abîme la lampe qui coûte cher. Laisser allumé jusqu’en fin de journée.
- Sorbonnes : pour une bonne utilisation, fermer presque complètement ou à moitié la vitre, sinon elle sonne car l’extraction d’air n’est pas correcte. Ne pas déplacer les bouteilles d’une hotte à l’autre, c’est le manipulateur qui se déplace.
- En cas de problème sur un appareil, consulter la liste des responsables des équipements et avertir la personne concernée.
Pour une bonne entente au sein du labo :

- Nettoyer les plans de travail « communs » après son passage. Ils doivent restés propres et rangés après utilisation (en particulier : hottes, balances, pHmètres, poste microbio...)
- Quand elles sont vides, remplir les bouteilles d’eau de Javel (pastilles chez Marie-Geneviève à diluer qsp 1 litre avec de l’eau du robinet), les pissettes d’éthanol 70° (stock dans la laverie), les pissettes et bonbonnes d’eau distillée.
- Pensez que vous n’êtes pas seul à manipuler et que le respect de chacun commence par le respect de l’état des lieux et matériels communs.
- Après 18 heures, fermer à clé automatiquement les portes de toutes les pièces.
-
Risque généraux dans un laboratoire
- Risques chimiques
- Risques biologiques
- Risques liés à l'exérimentation animale
- Risques radioactifs
- Manipulation de prélèvements humains en L2
L’utilisation de produits chimiques réactifs peut conduire à différents risques de nature physico-chimique (explosion, inflammation, dégagement de chaleur…) ou de nature toxique.
Les produits chimiques réactifs sont ainsi répertoriés dans différentes classes de danger :
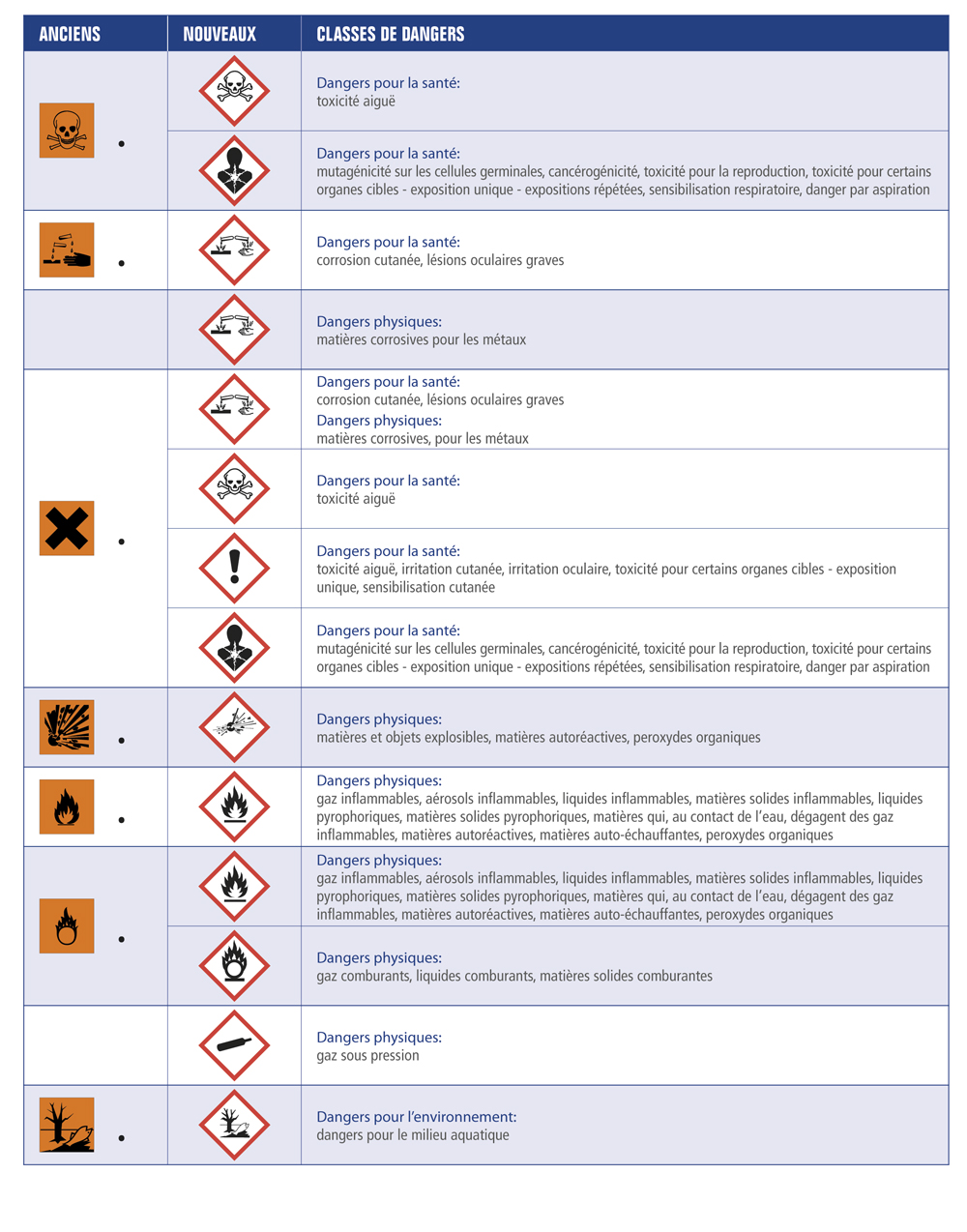
La toxicité d’un produit dépend aussi :
. de la quantité introduite dans l’organisme (dose)
. du caractère cumulatif des doses ou des effets
. de la voie de pénétration
. des aptitudes métaboliques de l’individu
. de l’état du sujet et des conditions du moment (fatigue, stress, etc…)
. des autres produits introduits dans l’organisme accidentellement ou non (autres toxiques, habitudes alimentaires, tabac, alcool, drogues, médicaments …)Les modes de contamination et la prévention sont résumés dans le tableau suivant :
Mode de
contaminationAgent causal Prévention Ingestion Risque présenté :
- par le pipetage oral
- par le port incorrect des gants, une mauvaise hygiène
- Interdiction de boire, fumer, manger dans le laboratoire
- Porter des gants
- Hygiène rigoureuse des mains
- Pipetage mécanique
Pénétration
par voie oculaireRisque présenté :
- par les projections et les aérosols
- Porter des lunettes
- Eviter la création d'aérosols
- Travailler sous sorbonne ou PSM (poste de sécurité microbiologique)
Pénétration
par voie cutanéeRisque présenté :
- par les projections
- le contact direct
- les blessures
- Porter des gants
- Eviter les projections
- Protéger particulièrement les segments de peau lésés (pansements)
Inhalation Risque présenté :
- lors des opérations de broyage, centrifugation
- lors des opérations de flambage, d'homogénéisation
- Travailler sous hotte
- Centrifuger en tube scellé ou fermé hermétiquement puis ouvrir les tubes sous sorbonnes ou PSM
- Ouvrir les ampoules sous sorbonne ou PSM
Avant toute manipulation, il est indispensable de connaître les risques et les précautions à prendre en lisant les fiches de données de sécurité et éventuellement les fiches toxicologiques ou au minimum les phrases de risques R & S.
Au laboratoire, ces fiches sont archivées par ordre alphabétique dans des classeurs situés sur l’étagère de la salle de pesées 209 (Si vous ne trouvez pas une fiche de données de sécurité, vous pouvez la rechercher sur Internet, vous entrez le nom du produit qui vous intéresse puis « SDS » ou « FDS »).
Lire attentivement les fiches de prévention affichées dans les laboratoires (au-dessus des sorbonnes et balances, et sur les portes).
Pour le transport de produit dangereux : caler le tube dans un récipient étanche, ne s’ouvrant pas en cas de chute. Prévoir 3 emballages (type « poupées russes »).
Penser à baliser tout local et/ou matériel en contact avec un produit à risque.
En cas d’accident avec dispersion du produit, baliser la zone contaminée, avertir ses collègues et s’équiper de façon adéquate pour décontaminer.
Si le produit est répandu sur le sol ou une paillasse, recouvrir de litière à chat (elle est stockée sur l’étagère au dessus de la paillasse de la salle de pesées 209) pour absorber le liquide. Jeter la litière dans le bidon pour déchets toxiques (seaux blancs) solides.
Si le manipulateur est contaminé, il doit retirer ses vêtements souillés et rincer à l’eau (pendant au moins 15 min) les parties du corps contaminées.
Toute personne manipulant un produit dangereux doit l’indiquer sur sa fiche individuelle d’exposition aux produits dangereux qui sera transmise annuellement à la médecine préventive.Produits chimiques dangereux utilisés au labo BioPeroxIL (liste non exhaustive) :
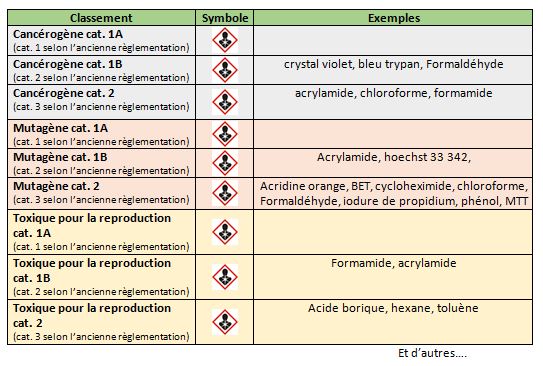
- Cancérigènes, mutagènes, toxiques pour la reproduction (CMR) : Acide borique (poudre), bleu trypan, bleu Evans, acridine orange, bromure d’éthidium, Hoechst, crystal violet, iodure de propidium, MTT, acrylamide, formaldéhyde, para-formaldéhyde, formamide, hexane, phénol, chloroforme, méthanol, toluène
- Très toxiques : azide de sodium, hygromycine B, actinomycine D, Wortmannine…
- Acides et bases fortes : HCl, NaOH, KOH (réactifs sur l’eau)
- Inflammables : acétone, éthanol, alcool isoamylique, butanol, isopropanol…
- Fluides cryogéniques : CO2 et N2 : toxiques par gelures pour l’homme
Cas particulier des produits Cancérogènes, Mutagènes, Reprotoxiques (CMR) :
Préalablement à toute manipulation, chaque personne manipulant des CMR doit avoir été formée par son encadrant ou l’assistant de prévention, ou avoir suivi une formation organisée par l’université. Elle doit également être autorisée par le médecin de prévention.
Il existe 3 catégories de risques selon la nouvelle réglementation "CLP":
• catégorie 1A : substance connue pour provoquer un risque
• catégorie 1B : substance fortement présumée pour provoquer un risque
• catégorie 2 : substance susceptible de provoquer un dangerRespectez particulièrement les consignes de manipulation.
Stockage : éviter la dissémination des lieux de stockage, baliser le lieu de stockage
Préparation de solutions : privilégier l’achat de solution pour éviter la manipulation de poudre, manipuler sous sorbonne ou hotte à flux laminaire pour préparer les dilutions, ne pas peser une quantité exacte (limiter les manip), prévoir un récipient incassable, résistant au produit et au solvant, hermétique
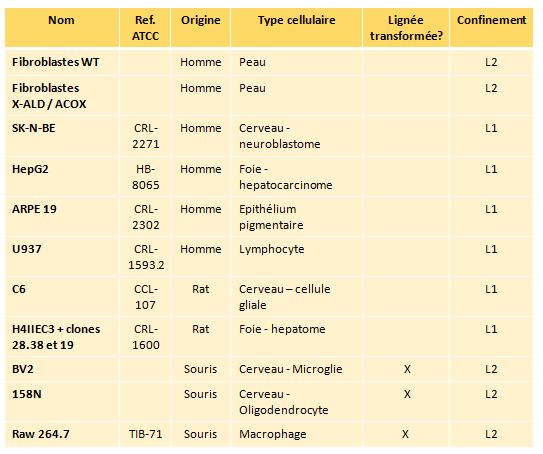
Il concerne les expérimentations en bactériologie et en culture cellulaire.
Avant toute manipulation, chacun doit savoir à quelle classe de pathogénicité pour l’homme appartient le micro-organisme qu’il va cultiver.
Le classement est le suivant :
Classe 1
Confinement L1
- Micro-organismes non génétiquement modifiés de classe 1 (n'ayant aucun pouvoir pathogène pour l'homme et ne constituant pas une menace pour l'environnement)
- Micro-organismes non pathogènes génétiquement modifiés portant des fragments d'ADN étranger sans pouvoir pathogène
- Cellules animales et végétales normales ou immortalisées et plantes transgéniques ne produisant pas de virus ou ne produisant que des virus de classe 1, Ea1 ou Ep1
Classe 2
Confinement L2
- Micro-organismes non génétiquement modifiés de classe 2 (qui peuvent provoquer des maladies chez l'homme mais dont la dissémination dans l'environnement est peu probable, qui sont sans risque pour la collectivité et contre lesquels une prophylaxie ou des traitements efficaces sont connus)
- Micro-organismes génétiquement modifiés de classe 2 dans lesquels les vecteurs ou les séquences clonées n'augmentent pas la classe de risque
- Micro-organismes non pathogènes génétiquement modifiés portant, soit des gènes codant pour des protéines ayant un pouvoir pathogène limité, soit des fragments importants de génome de micro-organismes de classe 2, Ea2 ou Ep2
- Cellules animales exprimant un virus de classe 2 ou Ea2
- Cellules animales abritant des vecteurs d'expression qui contiennent des gènes codant pour des protéines ayant un pouvoir pathogène limité ou des fragments de génomes humains ou d'animaux inconnus ou des fragments importants de génome de micro-organismes de classe 2 ou Ea2
- Cellules végétales et plantes transgéniques produisant des virus de classe Ep2
Au laboratoire BioPeroxIL, les micro-organismes utilisés en biologie moléculaire sont toutes des bactéries de classe 1.
Les lignées cellulaires animales utilisées en culture cellulaire peuvent être de classe 1 ou 2.Cependant, elles seront toutes cultivées en confinement 2 en salle 215A, 215B ou 215C.Liste non-exhaustive des lignées cellulaires cultivées au laboratoire BioPeroxIL :
Rappels généraux sur les bonnes pratiques en laboratoire de confinement 1 (L1) :
• Porter une blouse
• Porter des gants si nécessaire (plaie aux mains)
• Se laver les mains avant et après la manipulation
• Désinfecter le plan de travail avant et après la manipulation, ainsi qu’après une contamination
• Eliminer les déchets solides dans des conteneurs spécifiques (poubelles jaunes) ; inactiver (à la Javel) les liquides contaminés avant élimination à l’évier. Rq : Dans le cas des OGM de niveau I, les déchets solides seront également décontaminés à la Javel avant élimination dans les poubelles jaunes.
• Les aiguilles et matériels coupants usagés sont collectés dans une poubelle spéciale jaune (ne pas recapuchonner les aiguilles)
• En cas de contamination du matériel, nettoyer avec un détergent puis désinfecter à l’éthanol 70°
• Eviter la création d’aérosols et de projections :
◊ Une suspension de micro-organismes ne doit jamais être mélangée par aspirations et refoulements successifs à travers une pipette et chassée brutalement
◊ Il est recommandé de faire s’écouler les liquides le long de la paroi intérieure du tube en dessous de la surface du liquide contenu dans le récipient.
Rappels généraux sur les BP en laboratoire L2 :• Suivre une formation par son encadrant ou par l’assistant de prévention avant toute manipulation
• Porter une blouse spécifique, des gants (changés régulièrement)
• Manipuler seul, sous PSM de type II, dans une pièce ventilée réservée à la manipulation de micro-organismes de niveau II
• Utiliser du matériel présent dans la pièce uniquement
• Eliminer les déchets solides dans des conteneurs spécifiques (poubelles jaunes) ; inactiver les liquides contaminés avec de l’eau de Javel avant élimination à l’évier
• En cas de contamination du matériel, nettoyer avec un détergent puis désinfecter à l’éthanol 70°
• Eviter la création d’aérosols (voir ci-dessus)
• Participer au nettoyage régulier des équipements de culture cellulaire (incubateur, PSM, centrifugeuse…)Risques liés à l'expérimentation animale
Pour manipuler des animaux, il faut :
- être formé à l’expérimentation animale :
3 niveaux de formation possible :
niveau I : pour chercheur assurant la responsabilité scientifique directe de l’expérimentation sur les animaux et devant, pour cela, être titulaire d’une autorisation d’expérimenter
niveau II : personne, notamment technicien, appelé à participer directement aux expériences, en dehors des personnes titulaires d’une autorisation
niveau III : personnel animalier affecté à l’hébergement, à l’entretien et aux soins des animaux
- suivre la règle des 3 R
Remplacement : des espèces sensibles par des espèces moins sensibles ou « non vivantes » (in vitro)
Réduction : du nombre des animaux au minimum nécessaire à l’obtention de résultats valides, et aux seules expériences essentielles
Raffinement : i.e. réduction de la souffrance animale (anesthésiques et analgésiques indispensables)
Quels risques et quelles précautions ?
Contamination par des microbes portés par un animal apparemment sain : en particulier cas des zoonoses (peuvent être mortelles !)
A travers la peau : morsure, griffure, piqûre…
- laver au savon de Marseille puis désinfecter
• Prévention : gants de contention et latex, se laver les mains
Voie conjonctivale : aérosols, éclaboussures, oculaires de microscope contaminés, frottement des yeux avec des mains sales
- laver 15 min au rince-œil + collyre antiseptique selon le médecin
• Prévention : se laver les mains, porter des lunettes
Par ingestion : rare, en portant à la bouche des mains souillées
- ne pas faire vomir, ne pas faire boire, voir un médecin en urgence
• Prévention : pas de pipetage oral, lavage des mains, changement des gants, ne pas boire manger fumer, changer de blouse entre l’animalerie et les labos
Par inhalation : rare
• Prévention : éviter la production d’aérosols (balayage), ne pas fumer, porter un masque
Voir Catherine GONDCAILLE
Pour toute personne amenée à manipuler la radioactivité, une formation organisée annuellement par l’université est obligatoire.
-
Consignes générales en Hygiène et Sécurité


Chacun doit :
. se préoccuper de sa propre sécurité, de celle de ses collègues ainsi que de la préservation de l’environnement.
. s’informer des bonnes pratiques de travail, des dispositions à prendre en cas d’accident ou de sinistre et être conscient des responsabilités engagées.- Consignes de sécurité dans le bâtiment :
- Ne pas obturer les portes battantes (portes coupe-feu)
- En cas d’alarme incendie, se diriger sans précipitation vers la sortie en empruntant l’escalier de l’aile Nord (petit escalier en face de la salle 212) et se rendre sur la pelouse de l’esplanade, près de la statue métallique multicolore. Attendre l’autorisation du(des) serre-file(s) (Nathalie et Vivien) pour remonter dans le bâtiment.
- NE JAMAIS TRAVAILLER SEUL DANS LE LABO (voir courrier de Stéphane SAVARY en annexe)
- Aptitude au travail en laboratoire :
Toute personne doit informer la médecine préventive en cas de problème de santé majeur, d’allergie connue à un produit, d’asthme ou en cas de grossesse. C’est le médecin de prévention qui définira dans quelles conditions la personne peut travailler.
- Prévention des accidents :
Les causes les plus fréquentes d’accidents sont :
• le manque d’expérience
• la méconnaissance des installations et de l’organisation des manips
• la précipitationIl est donc nécessaire de :
S’informer et se former :
▪ auprès de ses collègues, de son responsable, de l’assistante de prévention
▪ auprès de ses collègues, de son responsable, de l’assistante de prévention▪ en consultant les fiches de données de sécurité des produits
Informer :
• en balisant les manips dangereuses (le balisage doit être propre, net, non exagéré et retiré dès que le danger n’existe plus).
Vérifier :
• le bon état du matériel à utiliser (electrodes, rotor, ...)
• respecter les consignes portées sur les étiquettes des produits chimiques ou sur les fiches de données de sécurité (voir paragraphe « risque chimique »)
• contrôler la qualité des produits (faire éliminer tout produit douteux, souillé, ancien, stocké depuis longtemps...)Se protéger :
• en apprenant à utiliser le matériel de protection collective (sorbonnes, hottes, appareil de détection ...)
• en se protégeant individuellement : gants, blouse, lunettes, masque, écrans ...
Attention en particulier aux yeux (si risques de projection, d’explosion...) et aux mains (en cas d’utilisation de produits corrosifs, de verrerie ...)S’organiser et repérer les situations dangereuses :
• situation potentiellement dangereuse : plusieurs manips indépendantes sur le même poste de travail, manip avec des étapes faites sur des postes différents
• reconstituer « l’environnement de sécurité » nécessaire à chaque manip
• remettre le lieu en état après chaque manip : rangement des appareils, évacuation adéquate des produits, nettoyageRespecter quelques règles simples :
• porter lunettes et blouses pour toute manipulation
• ne pas fumer, manger, boire, se maquiller dans le labo
• ne pas pipeter à la bouche
• ne pas inhaler un produit inconnu
• attacher ses cheveux lorsqu'ils sont longs
• avoir des chaussures qui protègent les pieds
• ne pas porter de vêtements flottants
• ne pas porter de lentilles de contact
• ne pas poser ses affaires personnelles sur ou sous les paillasses
• retirer sa blouse avant d'entrer dans les locaux de vie (bureau, salle détente/café, salle de réunion, toilettes) : laisser sa blouse dans les salles de manipGérer les premières urgences :
• appeler les contacts (rappel ici) en cas d’incendie, d’urgence médicale ou de problème technique
• en cas de feu dans le labo :
◊ activer une des alarmes situées dans le couloir, essayer d’éteindre le feu (s’il démarre) avec l’extincteur le plus proche• en cas d’urgence médicale : PROTEGER - EXAMINER - ALERTER - SECOURIR
◊ s’adresser à un « sauveteur secouriste du travail » (SST)(voir page 2 du livret ou ici)
◊ si vous êtes seul :
v si la victime parle : l’allonger, jambes surélevées, la rassurer, la couvrir, la surveiller. Ne rien donner à boire.
v si la victime ne parle pas :
° mais elle respire : la mettre en PLS (Position Latérale de Sécurité)
° et si elle ne respire pas : massage cardiaque• Présence d’une trousse de secours dans le placard de la cafétéria (croix rouge sur la porte du placard). Le contenu est vérifié et mis à jour une fois par an (ou plus si besoin) par Nathalie Bancod.
cas spécifiques :
• personne en feu : se rouler par terre, étouffer les flammes avec une blouse
• projection de produits corrosifs : lavage immédiat et prolongé (15 min minimum) à l’eau courante
• électrisation : couper l’alimentation, sinon s’isoler du sol avec un tabouret et tirer la victime par ses vêtements
• intoxication : gestes de premières urgences + tel au centre anti-poison 03 83 32 36 36 (ne pas faire vomir ou boire)
• hémorragies : comprimer le point de saignement.
• fractures : ne pas déplacer la victimeRemplir le registre d’hygiène et sécurité en cas d’incident (même mineur) ou d’accident (il est avec la pharmacie, dans le placard de la cafétaria du labo)
Droit de retrait :
En cas de danger présentant une menace pour votre vie ou votre santé, vous avez le « droit » de quitter votre poste de travail. Avertir immédiatement les personnes concernées de l’existence de ce danger.
-
Collaborations Internationales
- Prof. F. Fennira (Université de Tunis El Manar, Tunisie)
- Prof W.J. Griffiths (Oxystérols, métabolisme du cholestérol, Swansea University, Swansea, UK)
- Prof. M. Hammami / Dr A. Zarrouk (Biochimie Nutrition, Université de Monastir - Tunisie)
- Prof. L. Iuliano (Medical biochemistry, Sapienza University, Rome - Italie)
- Prof. M. Jadot (Université de Namur - Belgique)
- Dr V. Leoni ( Oxystérols, métabolisme du cholestérol, acides gras, acides organiques, University of Milano Bicocca, Milan, Italie )
- Prof. O. Masmoudi (Université de Tunis El Manar, Tunisie)
- Prof. B. Nasser (Biochimie Neurobiologie, Université Hassan 1er, Settat - Maroc)
- Prof. T. Netticadan (Pharmacologie, Unviversité De Mannitoba - Canada)
- Prof. N. O'Brien / Dr J. Mackrill (University college of Cork, Cork, Ireland)
- Prof. J.K. Reddy (Biochemistry, Université de Northwestern, Chicago - USA)
- Prof. I. Singh (MUSC Children's Hospital, Charleston - USA)
- Prof. C. Tringalli (Chimie organique, Université de Catane - Italie)
- Prof. R.J. Wanders (Biochemistry, Academic Medical Center (AMC) Université d'Amsterdam)

Laboratoire Bio-PeroxIL - EA 7270
Expertise / Prestation de service
Contacts
Secrétariat : Nathalie Bancod
tel : 03 80 39 62 37- fax : 03 80 39 62 50
courriel : Cette adresse e-mail est protégée contre les robots spammeurs. Vous devez activer le JavaScript pour la visualiser.